常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液:Na+,NH4+、S2—、NO3— |
| B.c(HSO4-)=0.1mol/L的溶液:K+、Ba2+、HCO3—、C1— |
| C.滴入少量苯酚显紫色的溶液:Na+、K+、I—、SO42— |
| D.能溶解碳酚钙的溶液:Na+、NH4+、C1—、Br— |
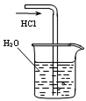
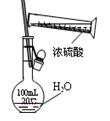
某课外实验小组设计的下列实验合理的是()
 |
 |
 |
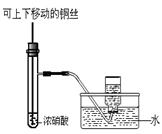 |
| A.制备少量氨气 |
B.吸收HCl制取稀盐酸 |
C.配制一定浓度硫酸溶液 |
 C.制备并收集少量NO2气体 C.制备并收集少量NO2气体 |
下列对氯及其化合物的说法正确的是()
| A.过量的铁在氯气中燃烧可生成氯化亚铁 |
| B.用pH试纸测得氯水的pH = 4 |
| C.溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色 |
| D.由Ca(ClO)2 + CO2 + H2O → Ca(HCO3)2 + 2HClO可推出Ca(ClO)2 + SO2 + H2O → CaSO3 + 2HClO |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 |
除杂试剂 |
分离方法 |
|
| A |
乙酸丁酯(乙酸) |
CCl4 |
萃取,分液 |
| B |
苯(苯酚) |
浓溴水 |
过滤 |
| C |
CH4(C2H4) |
酸性KMnO4溶液 |
洗气 |
| D |
溴苯(Br2) |
氢氧化钠溶液 |
洗涤,分液 |
下列溶液中能用来区别SO2和CO2气体的是()
①澄清的石灰水;②氯水;③酸性高锰酸钾溶液;④氯化钡溶液;⑤品红溶液
| A.①④⑤ | B.②③⑤ | C.①②③ | D.②③④ |
将小块生铁分别置于少量的饱和食盐水或稀醋酸溶液的试管中,一定时间后可观察到的现象是(忽略放置过程的热量变化)()