在2 L容积不变的容器中,发生N2+3H2 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
| A.1.6 mol | B.2.8 mol | C.3.2 mol | D.3.6 mol |
下列各原子或离子的电子排布式错误的是
| A.C 1s22s22p2 | B.O2- 1s22s22p6 |
| C.Cr 1s22s22p63s23p63d44s2 | D.Al3+ 1s22s22p6 |
瘦肉精在医学上称为“盐酸克伦特罗”。它是白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚,属β-兴奋剂类激素。是严重危害畜牧业健康发展和畜产品安全的毒品。其化学成分如图,下列有关盐酸克伦特罗说法错误的是 ( ) 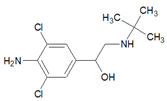
| A.分子式为C12H18Cl2N2O | B.分子结构中有1个手性碳原子 |
| C.能发生加成、取代、消去、氧化 | D.能溶于所有有机溶剂。 |
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )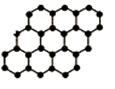
| A.石墨烯与石墨互为同位素 |
| B.0.12g石墨烯中含有6.02×1022个碳原子 |
| C.石墨烯是一种有机物 |
| D.石墨烯中的碳原子间以共价键结合 |
在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为16%,则混合物中碳元素的质量分数是()
| A.92.3% | B.87.6% | C.75.7% | D.84% |
有机物的结构用核磁共振仪处理后,得到右图所示的核磁共振氢谱,则该有机物可能是()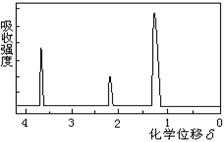
| A.C2H5OH | B.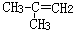 |
C. |
D. |