在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应 X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是
| A.C2H4、C3H8 | B.CH4、C5H8 | C.CH4、C4H8 | D.C2H6、C3H8 |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b | B.混合溶液的PH=7 |
C.混合溶液中,c(H+)= |
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-) |
下列除去杂质的方法正确的是
| A.除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离。 |
| B.除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏; |
| C.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶; |
| D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏。 |
苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生,这说明维生素C具有
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A. |
 的溶液中: 的溶液中:
 、 、
 、 、
 、 、

|
| B. |
由水电离的
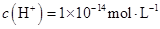 的溶液中: 的溶液中:
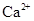 、 、
 、 、
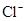 、 、

|
| C. |
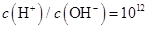 的溶液中: 的溶液中:
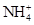 、 、
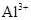 、 、
 、 、
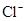
|
| D. |
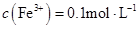 的溶液中: 的溶液中:
 、 、
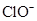 、 、
 、 、

|