铍(Be)与铝的性质相似,已知反应BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能进行完全。据此作出的以下推断中正确的是
| A.常温时,BeCl2溶液的pH >7 |
| B.常温时,Na2BeO2溶液的pH<7 |
| C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D.BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物 |
下列方程式书写正确的是()
A.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
B.H2SO3的电离方程式H2SO3 2H++SO32- 2H++SO32- |
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
D.CaCO3的电离方程式:CaCO3 Ca2++CO32- Ca2++CO32- |
工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g) =Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1 (Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是()
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应 |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是()
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是()
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
已知:(1)Zn(s)+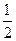 O2(g)===ZnO(s),ΔH1= -348.3 kJ·mol-1,
O2(g)===ZnO(s),ΔH1= -348.3 kJ·mol-1,
(2)2Ag(s)+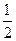 O2(g)===Ag2O(s),ΔH2=-31.0 kJ·mol-1,
O2(g)===Ag2O(s),ΔH2=-31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s)===ZnO(s)+ 2Ag(s)的ΔH等于( )
| A.-379.3 kJ·mol-1 | B.-317.3 kJ·mol-1 |
| C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
已知肼(N2H4)的燃烧热是534 kJ·mol-1,当它氧化生成1g水时,反应放出的热约为
| A.29.7 kJ | B.14.8 kJ | C.-29.7 kJ/mol | D.-14.8kJ/mol |