现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Li+、K+、Cu2+、Ba2+、Al3+ 和五种阴离子X、Cl-、OH-、NO3—、CO32—中的一种。已知E是LiCl。
(1)某同学通过比较分析,认为无须检验就可判断其余的四种物质中必有的两种物质是 和 (填对应物质的化学式)。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为 (填序号)。
①Br- ②SO42— ③CH3COO- ④HCO3—
(3)将19.2g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式 ,若要Cu完全溶解,至少加入H2SO4的物质的量是 mol。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤: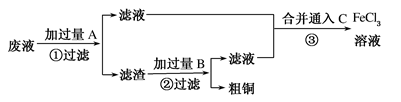
(1)写出FeCl3溶液与Cu反应的离子方程式___________,若Fe和Cu及稀硫酸构成原电池,_______可做负极材料。可通过向滤液中加入________(填化学式)溶液来检验Fe3+的存在,现象是__________。
(2)写出上图步骤③相关反应的化学方程式:③____________。C还可以用______(填化学式),用这种物质反应后不引入新的杂质。
(3)请写出焊接钢轨时发生反应的化学方程式 。
(本题共15分)在实验室可以在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL 乙酸,按下图所示(挟持和加热仪器略去)连接好装置进行实验,以制取乙酸乙酯。回答下列问题:
(1)浓硫酸的主要作用是①________,②________。
(2)试管B中盛放的溶液是________,B中通蒸气的导管不能插入溶液中目的是_______。
(3)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是________。
(4)制取乙酸乙酯的反应方程式是_____________,反应类型_ 。
(5)长的玻璃导管的作用是_ 。
(6)实验完成后,观察到试管B的液面上有透明的不溶于水的油状液体产生。可通过________(填操作名称)的方法进行分离。
(7)若要分离沸点不同且互溶的液体,该操作名称________。
(8)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_______________,反应类型是_________,请写出由乙醇制取乙烯的化学方程式 。
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)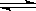 2SO3(g),△H=-Q,10分钟时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白
2SO3(g),△H=-Q,10分钟时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白
(1)从反应开始到达化学平衡,生成SO3的平均反应速为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是 (填标号,下同)。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时生成nmolO2
E.相同时间内消耗2nmolSO2的同时消耗nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.降低温度
D.使用催化剂
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(8分)有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A__________________________________
C:________________________________。