Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象
A. ;B. ;C. 。
从环保角度考虑,该装置有明显不足,请指出提出改进建议 。

Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
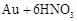  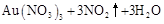 |
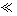 1 1 |
| 2 |
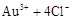  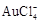 |
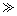 1 1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。
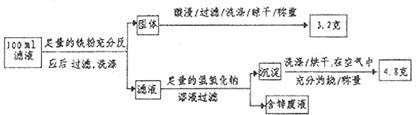
则 滤液中
滤液中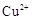 的浓度为
的浓度为 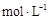 ,
,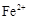 的浓度为
的浓度为 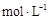 。
。
指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
(1)石蕊试纸(检验气体):。
(2)容量瓶:。
(3)酸式滴定管:。
(4)集气瓶(收集氯化氢):。
下列有关实验的叙述,正确的是(填序号) 。
| A.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶 |
| B.用渗析法分离淀粉中混有的NaCl杂质 |
| C.无法用分液漏斗将甘油和水的混合液体分离 |
| D.用酸式滴定管量取20.00mL高锰酸钾溶液 |
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
(14分)、海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: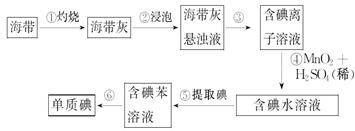
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在横线处)。______________
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 |
E.酒精灯 F.干燥器 G.坩埚钳
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。
(3)在步骤④中MnO2转变为Mn2+、I-转变为I2,请写出反应的离子方程式是___________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是___________________________________;_____________________________________________________________。
(5)、检验提取碘后的水溶液中是否还含有单质碘的试剂是:________________。
可用右图所示装置制取少量乙酸乙酯。请填空:
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是___________________________________
(2)为防止a中的液体在实验时发生暴沸,可在加热前采取的措施是__________。
(3)实验中加热试管a的目的是:
①_________________________________________;
②__________________________________________;
(4)、常用同位素示踪法来确定反应物断键的情况,请用乙酸中的氧用18O,乙醇中的氧用16O写出能表示制取乙酸乙酯断键情况的化学方程式:__________________。
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示: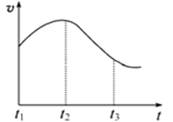
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原是,t2~t3速率变化的主要原因是。
(2)实验②放出氢气的量减少的原因是(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式:_________________________