某同学根据原电池的构成及其原理,设计了以下几个装置,以证明铁、铜金属性强弱顺序。你认为下列现象符合客观事实的是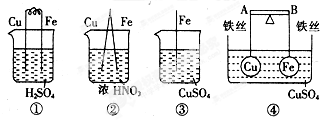
| A.装置①中:铁上有气泡 |
| B.装置②中:铜上有气泡 |
| C.装置③中:铁片上析出红色的铜 |
| D.装置④中:AB为导体,反应一段时间后,铁球向下倾斜 |
设阿伏加德罗常数为NA,下列说法中正确的是
| A.标准状况下,2.24L水含有0.1NA个水分子 |
| B.0.3molSO2中含有的氧原子数为0.3NA |
| C.标准状况下,22.4L氖气含有2NA个原子 |
| D.1L 0.1mol/LMgCl2溶液中含Cl-数为0.2NA |
污水处理的主要方法有:①中和法 ②化学沉淀法 ③氧化还原法 ④过滤法,其中属于化学变化的是
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是()
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
下列实验能达到目的的是
| A.用可见光束照射以区别溶液和胶体 |
| B.用萃取分液的方法出去酒精中的水 |
| C.通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 |
| D.只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4四种无色溶液 |
下列各组化合物中,化学键类型完全相同的是
| A.Na2O2和Na2O | B.MgCl2和Na2S | C.CaO和CO2 | D.HCl 和NaOH |