一定温度下,反应N2(g)+3H2(g)  2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A.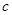 (N2): (N2): 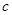 (H2): (H2): 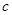 (NH3)=1:3:2 (NH3)=1:3:2 |
| B.N2、H2和NH3的质量分数不再改变 |
| C.N2与H2的物质的量之和是NH3的物质的量的2倍 |
| D.单位时间里每增加1 mol N2,同时减少2 mol NH3 |
已知晶体硅的燃烧热为989KJ/mol,且断裂1molSi-Si、Si-O需吸收的能量分别为176KJ, 460KJ,则1molO=O断裂时吸收的能量为()
| A.499KJ | B.2477 KJ | C. 245 KJ | D.1557 KJ |
根据下列实验现象,所得结论正确的是()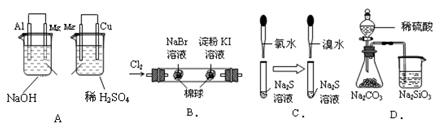
| 实验 |
实验现象 |
结论 |
| A. |
左烧杯中镁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Mg>Cu |
| B. |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C. |
左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 |
氧化性:Cl2>Br2>S |
| D. |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:S>C>Si |
下列离子方程式正确的是()
| A.向CaCl2溶液中通入少量CO2: Ca2+ + CO2 + H2O = CaCO3↓+ 2H+ |
| B.FeBr2溶液与等物质的量的Cl2反应:2Fe2+ +2Br - +2Cl2=2Fe3+ +4Cl-+Br2 |
| C.Fe3O4与稀硝酸反应:2Fe3O4 +18H+=6Fe3+ +H2↑+8H2O |
| D.向次氯酸钙溶液通入少量SO2:Ca2++ 2ClO- + SO2+ H2O = CaSO3↓ + 2HClO |
下列说法正确的是()
| A.红热的铜丝在Cl2中燃烧后生成蓝色的CuCl2 |
| B.工业上将NH3与CO2在高温高压下制成[CO(NH2)2] 是氮的固定过程 |
| C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以使SO3吸收完全 |
| D.工业制取单质硅时会产生大量导致“温室效应”的气体 |
在一种无色溶液中,可能存在Na+、Ca2+、Fe3+、Br -、CO32-、SO42-、Cl-离子中的几种。
某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加AgNO3溶液,有白色沉淀产生;(3)另一份加BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是()
A.Na+、Fe3+、SO42-B.CO32-、Cl-、SO42-
C.Ca2+、Br-、SO42-D.Na+、SO42-、CO32-