(14分,每空2分)某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 。漂白粉在空气中变质的原因 (用化学反应方程式说明)。
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
某研究小组制得一种有机物F,是一种新型镇痛和麻醉药物,可通过以下路线合成得到,线路如下:
已知信息:
(1)有机物D、E不能使FeCl3显紫色,有机物B的结构片断为
(2)
(3)
请回答下列问题:
(1)F分子式为,A中官能团为(任写一种)_______。
(2)反应②类型_________________.
(3)B的结构简式为。
(4)X是A的同分异构体,X的结构具有以下特征:①属于芳香族化合物;②属于酯类;③可以发生银镜反应。符合条件的X所有同分异构体有_________种。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯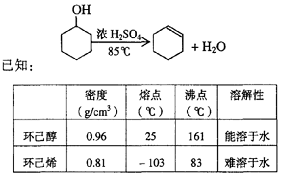

(1)制备粗品将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠c.测定沸点
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,
其目的是_________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是。
(3)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的是(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等 ⑤混合物中各物质的浓度不再变化
(4)(每空1分)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
E为____________(填名称);试剂a是__________,试剂b为_______;分离方法①是___________,分离方法②是__________________,分离方法③是__________。
(5)写出C → D 反应的化学方程式。
实验室用下图所示的装置制取乙酸乙酯。
(1)乙醇中含有的官能团名称为:_______;
乙酸中含有的官能团名称为:_______;
(2)浓硫酸的作用是
①_____________________;②____________________________。
(3)饱和Na2CO3溶液的作用____________________________________。
(4)实验生成的乙酸乙酯,其密度比水__________(填“大”或“小”),有__________气味。
中学实验室用如图所示装置制取少量溴苯。请填写下列空白。
(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起__________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:__________________________________。