下列现象不能用沉淀溶解平衡移动原理解释的是
| A.相同温度下,AgCl在水中的溶解度大于在氯化钠溶液中的溶解度 |
| B.浓FeCl3溶液滴入沸水加热形成红褐色透明液体 |
| C.自然界地表层原生铜矿变成CuSO4溶液向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS) |
| D.加入少量AgCl固体可以除去氯化钠溶液中的少量硫化钠杂质 |
下列有关物质的性质叙述不正确的是()
| A.蛋白质水解的最终产物都是α—氨基酸 |
| B.臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性 |
| C.工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质 |
| D.氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物 |
下列化学用语表达正确的是()
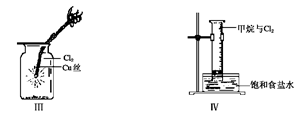
A.氯化钠的电子式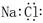 : : |
B.丙烷分子的比例模型: |
| C.NaHCO3的电离方程式NaHCO3=Na++H++CO32- |
| D.质子数为53,中子数为78的碘原子:131 53I |
生活中的一些问题常涉及到化学知识,下列叙述不正确的是()
| A.维生素C具有还原性,在人体内起抗氧化作用 |
| B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 |
| C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情。 |
| D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁。 |
某同学用下列装置制备并检验Cl2的性质。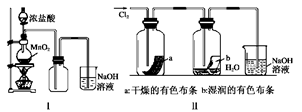
下列说法正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:量筒中发生了加成反应 |
关于硅及其化合物的叙述中,错误的是( )
| A.硅是良好的半导体材料 |
| B.二氧化硅能与石灰石反应:SiO2+CaCO3CaSiO3+CO2↑ |
| C.可以用焦炭还原二氧化硅生产硅:SiO2+2CSi+2CO↑ |
| D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2 |