下列实验的实验目的、图示操作和实验现象均正确的是
| A. 探究不同催化剂对同一反应速率的影响 |
B. 探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 |
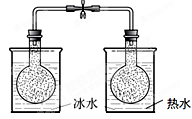 2NO2(g)  N2O4 △H<0 N2O4 △H<0试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C. 探究醋酸、碳酸、硼酸的酸性强弱 |
D. 验证外加电流的阴极保护法 |
 试剂:0.1 mol/L醋酸溶液、饱和硼酸溶液 0.1 mol/LNa2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 |
 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
下列叙述中,正确的是
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀
③电镀时应把镀件置于电解槽的阴极
④冶炼铝时,把氯化铝加热成为熔融态后电解
⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
某同学为完成反应:2HCl+2Ag=2AgCl↓+H2↑设计了下列四个实验,如图所示,你认为可行的是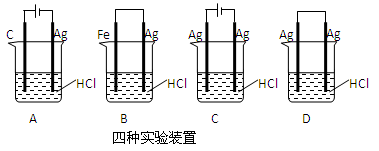
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸溶液以提高电解质的导电性 B放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加 D.放电时电池正极反应为:FePO4+e-+Li+=LiFePO4
2013年,科学家们发明了一种能够给电子设备提供动力的生物电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是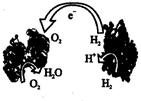
| A.左边为该电池的负极 | B.该电池可在高温环境下使用 |
| C.该电池负极反应为:H2-2e-==2H+ | D.该电池正极反应为:O2+4e-==2O2- |
下列过程或现象与盐类水解无关的是
| A.用热的纯碱溶液去油污 | B.铁在潮湿的环境下生锈 |
| C.加热氯化铁溶液颜色变深 | D.浓硫化钠溶液有臭味 |