氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示:
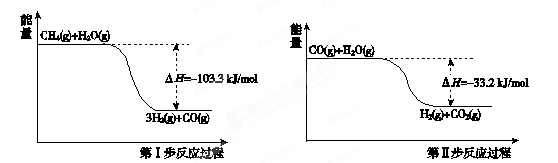
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,随着温度升高该反应的化学平衡常数的变化趋势是 。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是______(填序号)。
a. 四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
将镁、铝的混合物0.1mol 溶于100mL 2mol/LH2SO4溶液中,然后在得到的溶液中滴加1mol/LNaOH 溶液,请回答:
(1)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好完全沉淀,则加入NaOH溶液的体积是V(NaOH)=________mL。
(2)若在滴加NaOH溶液过程中,沉淀的质量随加入NaOH溶液的体积变化如下图所示。当V1=160mL时,求金属粉末中镁的物质的量和V2的体积?(要求写出解题过程)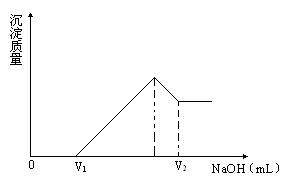
(3)若混合物仍为0.1mol ,其中Mg的物质的量分数为a,用100mL 2mol/L的H2SO4溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,则满足此条件的a的取值范围为。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
① 写出制取高铁酸钠的化学方程式:;
② 在制取高铁酸钠的反应中元素被氧化;
③ 高铁酸钠杀菌作用是利用了其具有的,而净水作用的原因是。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的溶液中逐滴加入氢氧化钠溶液,将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A1O2-+H2O=Al(OH)3↓+ NH3↑ ,试回答:
① 硫酸铝铵在水溶液中的电离方程式为;
②在向该复盐的溶液中逐滴加入氢氧化钠溶液,请在下图中画出加入氢氧化钠溶液的体积与沉淀物质的量之间的关系。
现有A、B、C、D、E五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同)。已知:①室温时,0.1 mol·L-1B溶液的pH=10,②C、D、E三种溶液的pH均小于7,③C溶液分别与其他四种溶液反应均生成沉淀,④A溶液与D溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸。
(1)试根据以上实验事实可以推断(用化学式表示)
B为_________;C为_________;D为________。
(2)写出下列反应的离子方程式:
A溶液与D溶液混合(加热);
C溶液与E溶液混合。
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒.降脂等药效,主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C.H质量分数分别为w(C)=35.82%.w(H)=4.48%;②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出33.6 L H2(气体体积均已折算为标准状况);③该分子中存在四种化学环境不同的碳原子,氢原子处于五种不同的化学环境。回答下列问题:
⑴苹果酸的分子式为,分子中有________个羧基。
⑵写出苹果酸的结构简式____________________________。
⑶苹果酸的同分异构体中,符合上述①.②两个条件的有(写出结构简式):、
.。
(1)现有一蛋白质分子由2条多肽链组成,共有肽键98个。已知构成这种蛋白质的氨基酸的平均分子量为128,则此蛋白质的平均相对分子质量最接近于
A.12800 B.11036 C.12544 D.12288
(2)如果有一蛋白质分子仅由1条多肽链组成,共有肽键98个。构成这种蛋白质的氨基酸的平均分子量为128,则此蛋白质的平均相对分子质量和上述(1)中的蛋白质的平均相对分子质量相等吗?(填:A.相等B.不相等)请说明原因
。