为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32- (aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:

①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因 。
某化学实验室需要0.2mol/L NaOH溶液500 mL和0.5 mol/L硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。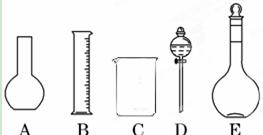
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___________(填写序号)。
①温度②浓度③容量④压强⑤酸式或碱式⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:mL(计算结果保留一位小数)。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏小(填写字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为、。
⑵该实验的实验步骤为:
①计算,②称量gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度;
④若定容时仰视刻度线。所配溶液的浓度;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度。
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。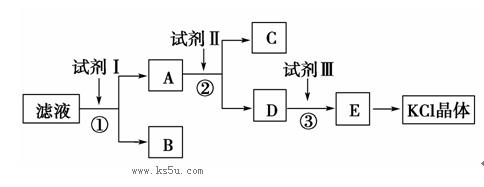
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应有
(填化学式)
(2)试剂Ⅰ、Ⅱ、Ⅲ的化学式分别为、、
(3)步骤①和②中,所用的玻璃仪器除胶头滴管,还应有
(4)步骤①中,判断试剂Ⅰ已加入过量的方法是:
(5)某同学根据最终所得KCl晶体和原样品的质量求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理 (不考虑实验误差):
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: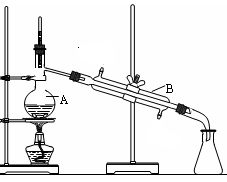
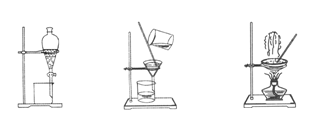
图1图2图3图4
(1)装置图1中A的名称是________,B的名称是。A 中一般要加入碎瓷片,其作用是。装置图4中盛溶液的仪器名称是。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: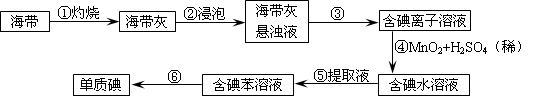
1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
2)步骤③的实验选择上述装置图(填图的序号)。步骤⑤的实验操作名称是________,
选择上述装置图(填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是________,选择上述装置图(填图的序号)
某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰②将海带灰浸泡得其悬浊液③过滤得含碘离子的溶液④向该溶液中加入适量Cl2置换出碘⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程可在下列那种仪器中进行_____________
| A.烧杯 | B.试管 | C.蒸发皿 | D.坩埚 |
(2)过滤用到的三种玻璃仪器主要
(3)用有机溶剂将碘从水中提取出来需用到下列哪套装置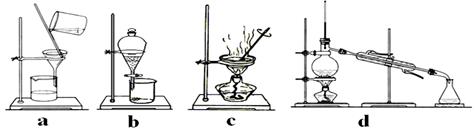
(4)若用四氯化碳作溶剂进行提取,则分层后下层物质为