根据下列操作及现象,所得结论正确的是
| 序号 |
操作及现象 |
结论 |
| A |
将0.1 mol·L-1氨水稀释成0.01 mol·L-1,测得 pH由11.1变成 10.6 |
稀释后NH3·H2O的电离程度减小 |
| B |
常温下,测得饱和Na2CO3溶液的pH大于 饱和NaHCO3溶液 |
常温下水解程度: CO32- >HCO3 - |
| C |
向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 |
温度升高,Fe3+的水解程度增大 |
| D |
溴乙烷与NaOH乙醇溶液共热产生的气体 通入KMnO4酸性溶液中,溶液褪色 |
产生的气体为乙烯 |
实验室可用下图装置(启普发生器)制取氢气。欲使得到氢气的速率加快,下列措施可行的是: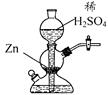
| A.将稀硫酸改用浓硫酸 |
| B.向稀硫酸中加入少量浓H2SO4 |
| C.向稀硫酸中加入Cu(NO3)2溶液 |
| D.给装置中发生反应的部分加热 |
在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g) 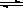 2SO3(g)+Q,下列叙述中,不正确的是:
2SO3(g)+Q,下列叙述中,不正确的是:
| A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 |
| B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高 |
| C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 |
| D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
下列物质中,导电性由大到小排列正确的是
①500mL 0.1mol/L 的盐酸溶液;②100mL 0.1mol/L 的硫酸溶液
③800mL 0.1mol/L 是醋酸溶液;④1L 0.1mol/L 的酒精溶液
| A.①②③④ | B.④①③② | C.②①③④ | D.①③②④ |
在pH=1溶液中能大量共存的离子组是
| A.MnO4-、 OH-、SO42-、Cl- | B.Fe2+、K+、NO3-、Al3+ |
| C.NH4+、Cu2+、SO42-、Cl- | D.NA+、CA2+、Cl-、HCO3- |
下列检验方法错误的是
| A.加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I- |
| B.加入盐酸酸化的BACl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42- |
| C.加NAOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中肯定存在NH4+ |
| D.某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO |