利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol |
能够证明甲烷分子空间结构为正四面体的事实是
| A.甲烷的四个碳氢键的键能相等 |
| B.甲烷的四个碳氢键的键长相等 |
| C.甲烷的一氯代物只有一种 |
| D.甲烷的二氯代物只有一种 |
反应C(s)+H2O(g) CO(g)+ H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.保持体积不变,充入H2使体系压强增大 |
| B.将容器体积缩小一倍 |
| C.增加C的量 |
| D.保持压强不变,充入N2使体系体积增大 |
aX(g)+bY(g)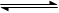 cZ(g)+dW(g)在一定体积的密闭容器中反应5 min达到平衡时,X减少n mol·L-1,Y减少
cZ(g)+dW(g)在一定体积的密闭容器中反应5 min达到平衡时,X减少n mol·L-1,Y减少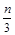 mol·L-1,Z增加
mol·L-1,Z增加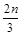 mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
| A.3∶1∶2∶1 | B.1∶3∶2∶2 |
| C.3∶1∶2∶2 | D.1∶3∶1∶2 |
对于放热反应H2+Cl2=2HCl,下列说法中,正确的是
| A.产物所具有的总能量高于反应物所具有的总能量 |
| B.反应物所具有的总能量高于产物所具有的总能量 |
| C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 |
| D.该反应中,化学能只转变为热能 |
实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是
| A.纯锌与稀硫酸反应 | B.纯锌和浓硫酸反应 |
| C.纯锌与稀盐酸反应 | D.粗锌(含铅、铜杂质)与稀硫酸反应 |