一个容积固定密闭容器中进行反应N2 + 3H2 2NH3,一定达到平衡状态的是
2NH3,一定达到平衡状态的是
①1个N≡N键断裂的同时,有3个H — H键形成;②1个N≡N键断裂的同时,有6个N — H键形成;③N2的体积分数不再改变;④容器的压强不再改变;⑤容器内气体的密度不再改变;
| A.①③④ | B.①②④ | C.①③⑤ | D.②③④ |
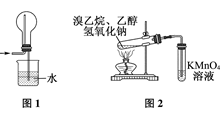
下列有关实验原理或操作正确的是( )
| A.SO2气体的还原性较强,不能使其通过浓硫酸干燥 |
| B.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 |
| C.用图1装置吸收多余的HCl气体 |
| D.用图2装置检验溴乙烷发生消去反应生成乙烯 |
下列离子或分子组中能大量共存,且满足相应要求的是( )
| 选项 |
离子或分子 |
要求 |
| A |
K+、NO、Cl-、HS- |
c(K+)<c(Cl-) |
| B |
Fe3+、NO、SO、Cl- |
滴加盐酸立即有气体产生 |
| C |
NH、Al3+、SO、CH3COOH |
滴加NaOH溶液立即有气体产生 |
| D |
Na+、HCO、Mg2+、SO |
滴加氨水立即有沉淀产生 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A.20mL 10mol·L-1的浓硝酸或浓硫酸与足量铜加热反应转移电子数均为0.2NA |
| B.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
| D.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
下列离子方程式不正确的是( )
| A.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O |
| B.将Na2O2固体投入H218O中:2H218O+2Na2O2===4OH-+4Na++18O2↑ |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO完全沉淀: 2Ba2++NH+Al3++2SO+4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO+20H+===4Fe3++3O2↑+10H2O |
下列说法正确的是( )
| A.氯水和过氧化钠都具有漂白作用,其漂白原理相似 |
| B.硅和二氧化硅都是重要的半导体材料 |
| C.蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程 |
| D.MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属 |