温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/ mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率大于80%
下列有关NaHCO3和Na2CO3性质的比较中,正确的是
| A.热稳定性:Na2CO3<NaHCO3 |
| B.常温时在水中的溶解度:Na2CO3<NaHCO3 |
| C.等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3 |
| D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多 |
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
| A.HCO3- | B.Cl- | C.Mg2+ | D.Na+ |
自来水可以用氯气消毒、某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是 ①AgNO3 ②FeCl3 ③AlCl3 ④ NaOH ⑤FeCl2 ⑥Na2CO3
| A.①②⑥ | B.③④ | C.②③ | D.④⑤⑥ |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是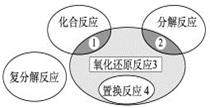
| A.Cl2+2KBr |
B.2NaHCO3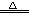 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O |
| D.2Na2O2+2CO2 |
归纳与推理是化学学习常用的方法。下列推理正确的是
| A.因为稀硫酸能与铁反应放出H2,所以浓硫酸与铁反应也一定能放出H2 |
| B.因为Na可以与水反应放出H2,所以K也可以与水反应放出H2 |
| C.因为CO2的水溶液可以导电,所以CO2是电解质 |
| D.因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |