某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
| A.C14H18O5 | B.C16H22O5 | C.C14H16O4 | D.C16H20O5 |
化学与生活密切相关,下列说法正确的是
| A.含有是食品添加剂的食物对人体健康均有害 |
| B.在食品袋中放入盛有CaO和硫酸亚铁的透气小袋,可防止食物受潮、氧化变质 |
| C.为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI |
| D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp(25℃) |
8.0×10﹣16 |
2.2×10﹣20 |
4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水。乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是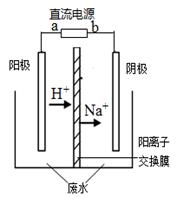
| A.电解过程中,阴极附近的乙醛被氧化 |
| B.阳极反应CH3CHO-2e-+ H2O ="==" CH3COOH +2H+ |
| C.若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 |
| D.现处理含1mol乙醛的废水,至少需转移1mol电子 |
下列电解质溶液的有关叙述正确的是
| A.同浓度,同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO3-) |
| D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
化学是以实验为基础的科学。下列关于各实验装置的叙述正确的是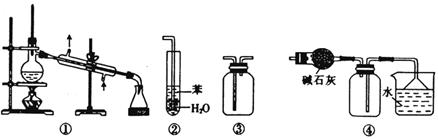
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |