某实验小组用下列装置进行乙醇催化氧化的实验.
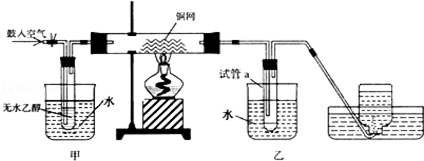
(1)实验中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式: .
不断鼓入空气,熄灭酒精灯,反应仍能继续,说明乙醇的氧化应是 反应.
(2)甲和乙两个水浴作用不相同.甲的作用是 ;乙的作用是 .
(3)反应进行一段时后,试管a中能收集到不同的物质,它们是 .集气瓶中收集到的气体的主要成分是 .
(4)若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还有 .
要除去该物质,可先在混合液中加入 (填写字母).
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填实验操作名称)即可除去.
(14分)为研究盛装浓硫酸的铁质材料(碳素钢)与浓硫酸的反应,某学习小组进行了以下探究活动:
[实验]取一铁钉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为x中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)
KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性:KMn04溶液
②为分析气体成分,乙同学取448mL(标准状况)气体Y通人足量溴水中,发生的反应式为:Br2+SO2+2H20====2HBr+H2S04,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g
[提出猜想]
分析上述实验中SO2的体积分数的结果,同学们认为Y中还可能含有其它气体并作如下
猜测:
猜想一:Y气体中可能含有H2;
猜想二:
猜想三:
[设计实验,验证猜想]
为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省
略)。
(1)实验装置连接次序为A→→→F→→F
(2)装置B中试剂作用是。
(3)猜想一的理由是(用化学方程式表示)。
(4)如果猜想一成立,预计实验现象应该是。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
实验室需要配制2.0mol·L-1的NaCl溶液500 ml 。
(1) 本实验所必需的仪器有托盘天平(精确到0.1g)、药匙、烧杯、量筒、玻璃棒、胶头滴管、以及等质量的两片滤纸。
(2)某学生在摇匀后发现液面低于刻度线再加水,会导致结果(填“偏高”、“偏低”、“无影响”)。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗液体未流下,你认为原因可能是
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
__________________________________________________________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_________________________,D:____________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl 2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
(1)下图为常见仪器的部分结构(有的仪器被放大)A图中液面所示溶液的体积为mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____(填字母标号)。
(2)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O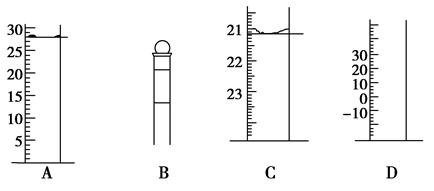
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三:。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验(“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。
③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_______,最后又变慢的原因是。④请写出步骤三的操作内容。⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为mol·L-1。