(9分)钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一。
(1)请写出铝原子的基态电子排布式:________。
(2)X+、Y2-、Z-与Al3+具有相同的电子层结构,则下列说法正确的是________。
| A.元素第一电离能:X>Al |
| B.电负性:Z>Y |
| C.氢化物稳定性:H2Y>HZ |
| D.H2Y中Y的杂化类型是sp3,键角小于109.5° |
(3)某钙钛型复合氧化物晶胞结构如图①所示,以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有磁电阻效应。该钙钛型复合氧化物的化学式为________。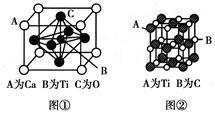
(4)最近发现钛(Ti)原子和碳原子可构成气态团簇分子,分子模型如图②所示。该气态团簇分子的分子式为________,它属于________晶体,其主要物理性质有________(写出两点即可)。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.分液 | B.升华 | C.结晶 | D.蒸发 E.蒸馏 F.过滤 |
(1)______分离豆浆与豆渣的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和食用调和油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(5)______用海水晒盐。
(6 分)现有下列四种物质:Na2SO4、BaSO4、蔗糖(C12H22O11)、H2SO4,按照一定的依据,能找出一种物质与其它三种物质不同,从而分成两类。请你试试看,一共能找出多少种分法,把分类的依据和结果写在下面的表格中。(填三种即可)
| 与其它三种不同的物质 |
分类依据 |
甲溶液可能含有 、
、 、
、 、
、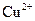 、
、 、
、 、
、 、
、 八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的 浓溶液并加热,产生的气体在标准状况下体积为4.48L。
浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6mol/L的 溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1mol/L 溶液650mL,恰好可完全反应。据此,请回答下列问题(用相应的离子符号表示):
溶液650mL,恰好可完全反应。据此,请回答下列问题(用相应的离子符号表示):
(1)上述实验③中得到沉淀X的质量为__________________;生成沉淀X的离子方程式为_____________________________________。
(2)甲溶液中一定不存在的离子是______________;可能存在的离子是____________。
(3)甲溶液一定存在的离子中,物质的量最大的离子是___________;物质的量最小的离子是_____________,此物质的量最小的离子其物质的量为____________。
标准状况下,向10L由 、
、 、
、 、
、 组成的混合气体中通入
组成的混合气体中通入 ,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通入盛有过量
,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通入盛有过量 溶液的洗气瓶气体的体积变为2L,这2L气体的密度是相同状况下
溶液的洗气瓶气体的体积变为2L,这2L气体的密度是相同状况下 密度的15.5倍。则原混合气体中各种气体的体积(以上数据均在标准状况下测定)为:
密度的15.5倍。则原混合气体中各种气体的体积(以上数据均在标准状况下测定)为: _______________;
_______________; _________________;
_________________; _______________;
_______________; _________________。
_________________。
请将5种物质: 、
、 、
、 、
、 和
和 分别填入下面对应的横线上,组成一个未配平的化学方程式。
分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_______+_______——_______+_______+_______+ 。
。
(2)反应物中发生氧化反应的物质是___________,被还原的元素是____________。
(3)反应中1mol氧化剂___________(填“得到”或“失去”)___________mol电子。
(4)请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
□________+□________——