化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负 极材料是 ,负极发生的电极反应方程式为: 。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为 mol。

(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(3)下图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为 。

【物质结构与性质】2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖。制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料。回答下列问题:
(1)氮和砷(As)位于同一主族,二者中电负性较大的是 (填元素符号,下同),第一电离能较大的是 。
(2)基态Zn 原子的价电子排布式为 ,价层电子占有的原子轨道数为 。
(3)Al2O3的熔点很高,Al2O3属于 晶体。Al2O3的熔点比NaCl 高,其原因是 。
(4)碳化硅的晶胞结构如图所示,其中白球代表的是 原子,一个晶胞中含有该原子的个数为 。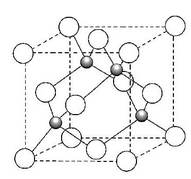
【化学与技术】钛铁矿的主要成分可表示为FeTiO3(Ti 为+4 价),某钛铁矿中含FeTiO3 为76%。钛白粉在涂料、塑料、油墨、造纸等行业具有广泛的用途,钛白粉的主要成分为TiO2。利用该钛铁矿生产钛白粉及绿矾的工艺流程如下: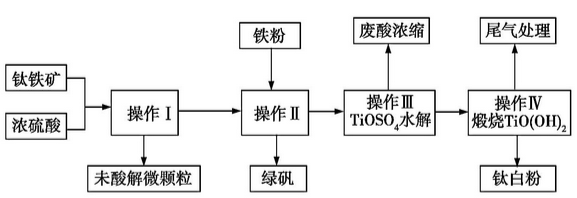
(1)若钛铁矿与浓硫酸反应时Ti 的转化率为92%,操作Ⅰ~Ⅳ中Ti 的转化率均为96%,则1t 该矿石可生产钛白粉(TiO2) t (计算结果保留两位小数,下同),能否计算生成的绿矾(FeSO4·7H2O)的质量? (能则写出计算结果,不能则说明理由)。
(2)钛铁矿与硫酸的反应可表示为FeTiO3+H2SO4 →TiOSO4+X+H2O(未配平)。其中X的化学式为 。
(3)操作Ⅰ的名称是 ,操作Ⅱ包括冷却结晶、 。操作Ⅱ中加入铁粉的目的是 (用离子方程式表示)。
(4)写出操作Ⅲ中TiOSO4水解的化学方程式: 。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。如图是以铁屑为原料制备K2FeO4的工艺流程图:
请回答下列问题:
(1)氯气与铁屑反应生成FeCl3的条件是 ,其生成物氯化铁也可作净水剂,其净水原理为 。
(2)流程图中的吸收剂X 为 (选填字母代号)。
a.NaOH 溶液 b.Fe 粉
c.FeSO4溶液 d.FeCl2溶液
(3)氯气与NaOH 溶液反应生成氧化剂Y 的离子方程式为 。
(4)反应④的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为 。
(5)K2FeO4的净水原理是 ,该反应生成具有吸附性的Fe(OH)3。用上述方法制备的粗K2FeO4需要提纯,可采用重结晶、洗涤、低温烘干的方法,洗涤剂可选用稀KOH 溶液,原因是 。
,该反应生成具有吸附性的Fe(OH)3。用上述方法制备的粗K2FeO4需要提纯,可采用重结晶、洗涤、低温烘干的方法,洗涤剂可选用稀KOH 溶液,原因是 。
(6)测定制备的粗K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
现称取1.98 g 粗K2FeO4样品溶于适量KOH 溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。每次取25.00 mL 加入稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中K2FeO4的质量分数为 。
粗锡的主要成分是锡,另外含有锌、铜、银、金等杂质。如图甲是工业上用电解法提
纯粗锡的一种工艺流程,电解装置如图乙所示。
(1)流程图中的硅氟酸(化学式为H2SiF6)是一种强酸,其中Si 的化合价为 ,其电离方程式为 。
(2)硅氟酸有腐蚀性,能与SiO2反应。电解粗锡可选取的电解槽有 (选填字母代号)。
a.玻璃电解槽b.石英电解槽
c.塑料电解槽 d.蜡制电解槽
(3)粗锡为电极 (选填“a”或“b”),该电极为 (选填“阳极”或“阴极”),电极反应式为 。
(4)阳极泥中含有的主要物质为 (写化学式)。
(5)若电解时采用SnCl2溶液作为电解液,当阴极增重11.90 g 时,电解质溶液减少的质量为0.54 g,则粗锡减少的质量为 (结果保留两位小数,不考虑进入阳极泥的物质)。
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为________________。
(2)所得溶液中Cl-的物质的量为______________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________________。