Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
(3)某同学在10 mL H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是 。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
《化学反应原理》
(1)本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是()
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
(2)热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示()
CO(g)+H2(g);△H =+131.3kJ/mol表示()
A.碳和水反应吸热131.3kJ
B.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
C.1mol碳和1mol水反应生成一氧化碳和氢气并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
(3)银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。工作时原电池的总反应是:Ag2O+Zn+H2O===2Ag+Zn(OH)2,根据上述变化判断:
①原电池的正极是___ __。
②工作时原电池两极反应式为:
负极_______________,正极______________
③工作时原电池负极附近的pH值________(填“增大”、“不变”、“减小”)
《化学与生活》
(1)化学与生活息息相关。下列叙述正确的是
A.鲜榨橙汁遇到碘水会变蓝 B.馒头越嚼越甜
C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒
(2)把新制的Cu(OH)2悬浊液加入到某病人的尿液中并微热,如果观察到红色沉淀,说明尿液中可能含有的物质是()
A.食醋 B.白酒 C.食盐 D.葡萄糖
(3)我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
①下列措施中,你认为减少酸雨产生的途径可采用的是。(用字母表示)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃烧脱硫煤
D.在已酸化的土壤中加石灰 E.开发新能源
②在英国进行了一个研究,结果表明:高烟囱可以有效地降低其周围地表面SO2浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱,结果使附近地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
室温下,单质A为日常生活中使用最广泛的金属;单质B为黄绿色气体,单质C为常温常压下密度最小的无色气体。在合适的条件下,它们可以按如图所示进行反应,又知D溶液为黄色,E溶液为无色。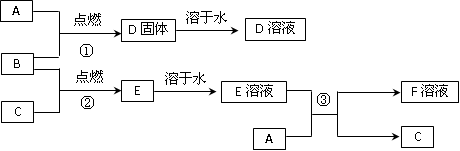
(1)写出下列物质的化学式:
D________________; E _________________; F ____________________。
(2) 写出F溶液在空气中与氢氧化钠溶液反应的化学方程式:____________________。
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
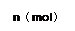  |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b=,e=
(2)20s—40s内用N2O4表示的平均反应速率为_;80℃该反应的化学平衡常数K为 __。
(3)改变条件达到新平衡,要使NO2在平衡体系中体积分数变小,采取的措施有。A.向混合气体中再通入N2O4 B.保持容积不变,通入He C.使用高效催化剂 D.降低温度
(4) 如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在
该图中补画出该反应在60℃时N2O4物质的量的变化曲线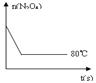
(12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)X的电极名称是(填写“阳极”或“阴极”)。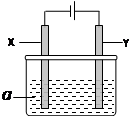
(2)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,
同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近
观察到的现象是,Y极上的电极反应为。
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是,Y电极的材料是。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |