碘在工农业生产和日常生活中有重要用途。
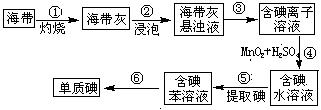
(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.冷凝管
步骤④发生反应的离子方程式为 。
若步骤⑤采用裂化汽油提取碘,后果是 。
(2)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为: IBr+H2O==HBr+HIO,下列有关IBr的叙述中错误的是: 。
A.固体溴化碘熔沸点较高
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(3)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)形式存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,请写出反应的离子方程式: 。
碳酸钙常用作牙膏 的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨,则石灰石中碳酸钙的质量分数为%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为
。
(3)第③步反应一般不采用通入CO2的主要原因是 ,相应的离子方程式为。
,相应的离子方程式为。
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是。
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下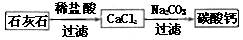
与前一方案相比较,该方案的优点是。
现有下列两组物质:
① H2、CaCO3、HCl、NH3
② 氯化钠溶液、硫酸铜溶液、氢氧化铁胶体、硫酸铁溶液。
请你从组成的元素、物质的性质等多个角度用两种不同的分类标准,从每组中选出一种不同类的物质,并指出其分类标准,写在下面相应的表格内。
| 组别 |
分类标准 |
不属于该类别的物质 |
| 第①组 |
H2 |
|
| 气体 |
||
| 第②组 |
||
铁跟氯气在点燃条件下发生反应:2Fe +3Cl2  2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作氧化剂,具有性。在该反应中,若消耗了1 mol Fe,则转移_______mol 电子。
2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作氧化剂,具有性。在该反应中,若消耗了1 mol Fe,则转移_______mol 电子。
⑴写出NaHCO3的电离方程式
(2)写出离子反应方程式Ba2++SO42-=BaSO4↓所对应的一个化学方程式。
(1)在标准状况下,某气体的密度为2.86 g/L,则其相对分子质量为___________(取整数值)。
(2)1.2 g RSO4中含0.01 mol R2+,则R的摩尔质量是。