设NA为阿伏加德罗常数的值。下列说法正确的是
| A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3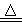 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
向100 mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示。下列分析错误的是.
A.原混合酸溶液的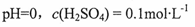 |
B.OA段的反应为: |
C.AB段的反应为: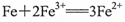 |
| D.BC段气体产物为氢气 |
己知: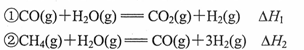
下列推断正确的是
A.若CO的燃烧热为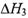 ,则H2的燃烧热为 ,则H2的燃烧热为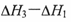 |
B.反应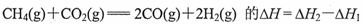 |
C.若反应②的反应物总能量低于生成物总能量,则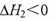 |
D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则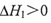 |
250C时,物质的量浓度相等的NaHCO3, CH3COONa混合溶液中,下列有关说法或粒子浓度关系正确的是(Ka表示CH3COOH的电离平衡常数)
A.pH可能等于7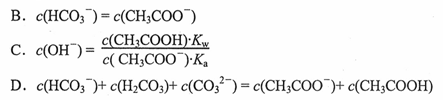
电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示。下列有关说法错误的是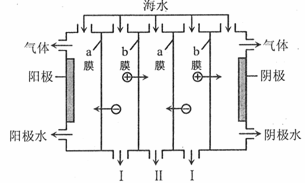
A.阳极可发生电极反应: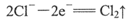 |
| B.阴极附近溶液的pH减小 |
| C.a膜为阴离子交换膜, b膜为阳离子交换膜 |
| D.I、II分别是淡水、浓海水出口 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.4gNaOH固体所含电子总数为2NA |
| B.22.4LC2H6所含化学键总数为7 NA |
| C.常温常压下,14gCO、N2混合气体所含分子总数为NA |
| D.0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |