下列各组热化学方程式中,△H1>△H2的是
①C(s)+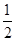 O2(g)="==CO(g)" △H1 C(s)+O2(g)===CO2(g) △H2
O2(g)="==CO(g)" △H1 C(s)+O2(g)===CO2(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+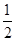 O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
| A.①③④ | B.②③④ | C.①②③④ | D.①②③ |
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3③Al(OH)3④Al
| A.③④ | B.②③④ | C.①③④ | D.全部 |
下列离子在溶液中能大量共存的是
将适量的铁粉加入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比
| A.3:2 | B.1:2 | C.2:1 | D.2:3 |
将4.34克Na、Na2O、Na2O2混合物与足量的水反应,在标准情况下得到672ml气体,将该混合气体通过电火花点燃,恰好完全反应,则它们的物质的量之比为()
| A.1:1:1 | B.1:1:2 | C.1:2:1 | D.4:3:2 |
由 四种金属中的两种组中的混合物10 g,与足量的盐酸反应产生的
四种金属中的两种组中的混合物10 g,与足量的盐酸反应产生的 在标准状况下为11.2L,则混合物中一定含有的金属是()
在标准状况下为11.2L,则混合物中一定含有的金属是()