某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:①取少量溶液加氢氧化钠溶液过程中无沉淀生成;②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:
| A.该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
可逆反应①X(g)+2Y(g) 2Z(g) 、②2M(g)
2Z(g) 、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: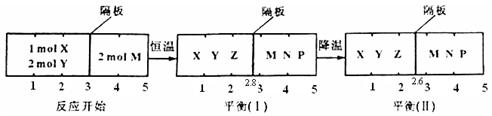
下列判断正确的是
| A.反应①的正反应是吸热反应 |
| B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 |
| C.在平衡(I)和平衡(II)中M的体积分数相等 |
| D.达平衡(I)时,X的转化率为5/11 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。则下列说法正确的是
| A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B.NF3是一种无色、无臭的气体,因此NF3泄漏时常常不易被察觉] |
| C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D.若反应中转移的电子数目为6.02×l023,则生成22.4L NO气体 |
某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈酸性,Na2HXO4溶液呈碱性。50℃时,浓度均为0.1mol?L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
| A.c(H+)?c(OH-) > 1×10-14 |
| B.c(Na+)+ c(H+)=c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-) |
| C.c(H+) + 2c(H3XO4) + c(H2XO4-) =c(XO43-) + c(OH-) |
| D.c(H+) + c(H3XO4)=c(HXO42-)+ 2c(XO43-)+ c(OH-) |
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)  Si(s)+4HCl(g)△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g)△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应 |
| C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min) |
| D.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ |
CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:
下列说法不正确的是
| A.咖啡酸分子中所有原子可能处在同一个平面上 |
| B.可用金属Na检测上述反应是否残留苯乙醇 |
| C.1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
| D.1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |