NA代表阿伏加德罗常数值,下列说法正确的是
| A.78gNa2O2所含有的离子数为3NA |
| B.1mol甲基中含有电子数为10NA |
| C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA |
| D.1molC10H22分子中共价键总数为22NA |
下图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指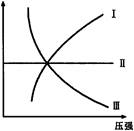
①N2(g)+3H2(g)  2NH3(g);△H=-Q
2NH3(g);△H=-Q
②H2(g)+I2(g)  2HI(g); △H=+Q
2HI(g); △H=+Q
③CO(g)+2H2(g) CH3OH(g); △H=-Q
CH3OH(g); △H=-Q
④2SO3(g)2 2SO2(g)+O2(g); △H=+Q
2SO2(g)+O2(g); △H=+Q
| A.平衡混合气中一种反应物的物质的量 | B.平衡混合气中一种反应物的百分含量 |
| C.平衡混合气中一种生成物的转化率 | D.平衡混合气中一种反应物的转化率 |
对于反应A(g)+2B(g)  2C(g) △H < O,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g) △H < O,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
在地壳内,深度每增加1km,压强大约增加25250~30300kPa,在这样的压强下,对固体物质的平衡会发生较大的影响。如:CaAl2Si2O8+Mg2SiO4=CaMg2Al2Si3O12
(钙长石) (镁橄榄石)(钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 413.6
密度(g/cm3) 2.70 3.22 3.50
在地壳区域变质的高压条件下,有利于
| A.钙长石生成 | B.镁橄榄石生成 |
| C.钙长石和镁橄榄石共存 | D.(钙镁)石榴子石生成 |
由可逆反应测绘出图象如下图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是
| A.反应物中一定有气体 | B.生成物中一定有气体 |
| C.正反应一定是放热反应 | D.正反应一定是放热反应 |
可逆反应mA(g)+nB(g)  pC(g)+qD(g),在密闭容器中反应达到平衡,改变某一条件后,正反应速率增大,则下列说法正确的是
pC(g)+qD(g),在密闭容器中反应达到平衡,改变某一条件后,正反应速率增大,则下列说法正确的是
| A.A的转化率增大 | B.平衡向逆向移动 |
| C.平衡没有移动 | D.上述三种情况都有可能 |