溴、碘主要存在于海水中,有“海洋元素”的美称.海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘.提取碘的途径如下所示:
下列有关叙述正确的是
| A.碘元素在海水中也有游离态存在 |
| B.操作A是结晶或重结晶 |
| C.B是提纯操作,常用蒸馏 |
| D.在提取的过程中用的氧化剂可以是H2O2 |
NA代表阿伏伽德罗常数,下列说法正确的是
A.标准状况下,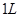 乙醇完全燃烧产生 乙醇完全燃烧产生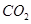 分子的数目为 分子的数目为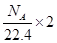 |
| B.磷酸的摩尔质量与NA个磷酸分子的质量之和相等 |
| C.16gO2、O3的混合物所含的氧原子数目为NA |
| D.1molOH-所含的质子数为10NA |
vL Fe2(SO4)3溶液中含有a克SO42-,取此溶液0.5vL,用水稀释至2vL,则稀释后溶液中Fe3+的物质的量的浓度为
A.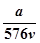 mol/L mol/L |
B.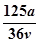 mol/L mol/L |
C.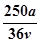 mol/L mol/L |
D.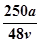 mol/L mol/L |
下列溶液中的Cl- 数目与25mL 0.1 mol·L-1的AlCl3溶液中Cl-数目相等的是
| A.50mL 0.15mol·L-1的BaCl2溶液 | B.50mL 0.3mol·L-1的NaCl溶液 |
| C.25 mL0.3mol·L-1的FeCl3溶液 | D.75 mL 0.1mol·L-1的KCl溶液 |
标准状况下,CO2和N2的混合气体的质量是9.6g,体积是6.72L,则CO2在混合物中的质量分数约为
| A.25% | B.34% | C.75% | D.50% |
含溶质24g的3mol/LNaOH溶液,现欲配制成1mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为
| A.1∶2 | B.1∶3 | C.2∶1 | D.2∶3 |