把含有氧化铁的铁投入到足量的稀硫酸中,直到固体全部溶解,经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的氢气的物质的量之比为10:7,则原混合物中单质铁的质量分数为
| A.26.3% | B.73.7% |
| C.88.2% | D.95.1% |
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,负极反应为:Zn+2OH--—2e-==ZnO+H2O;正极反应为:Ag2O+H2O+2e-="=2Ag+2OH-" ,根据反应式,判断下列叙述正确的是
| A.在使用过程中,电池正极区溶液的pH增大 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.氢氧燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
| A.电池的负极反应为Mg-2e-===Mg2+ |
| B.电池工作时,H+向负极移动 |
| C.电池工作一段时间后,溶液的pH增大 |
| D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O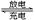 Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
下列说法中正确的是
| A.放电时,负极上发生反应的物质是Fe |
B.放电时,正极反应是:NiO2+2e—+2H+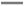 Ni(OH)2 Ni(OH)2 |
C.充电时,阴极反应是:Ni(OH)2-2e—+2OH—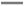 NiO2+2H2O NiO2+2H2O |
| D.充电时,阳极应该是镍元素化合价降低 |
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O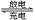 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某
种碱性电解质溶液中
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |