A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素 |
元素性质或结构 |
| A |
最外层电子数是其内层电子数的2倍 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 。
(2)B最简单气态氢化物的电子式 ,属于 化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式 ,所含化学键类型: 。
(3)B、C、D、E简单离子半径由大到小顺序为: ﹥ ﹥ ﹥ (填元素符号)。
(4)用电子式表示E的氢化物的形成过程 。
(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式: 。
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为 。
有几种元素的微粒的电子层结构如图所示,其中:
(1)某原子微粒性质很稳定,一般不和其他元素的原子反应,这种微粒符是____________;
(2)某微粒的盐溶液,加入AgNO3溶液时会出现白色沉淀,这种微粒符号______________;
(3)某原子失去一个电子得到该微粒,则这种微粒的符号是____________________;
(4)某原子得到两个电子得到该微粒,则这种微粒的符号是____________________。
将下列硅酸盐改写成氧化物的形式(aMxOy•bSiO2•cH20)。
①镁橄榄石(Mg2SiO4)_________________________________;
②高岭石Al2Si2O9 H4____________________________________。
选择合适的序号填空
A.12C、13C、14CB.S2-、Cl—、Na+
C.金刚石、石墨、C60D.Na+、Ne、F-
属于同素异形体的是,同位素的是,最外层电子数相同的微粒是,电子层数相同的微粒是,化学性质基本相同的是。
选择合适的序号填空
| A.氢氧化铝 | B.二氧化硅 | C.硅 | D.铝热剂 E.铝合金 |
可广泛做为半导体的是,用于净水的是,可做光导纤维的是,用于焊接钢轨的,具有抗腐蚀性强、密度小、强度高等优点的是。
E是某类化妆品生产的常用添加剂(香料),工业上以Y、X为主要原料合成,其中Y的产量可以用来衡量一个国家石油化工发展水平产品,其流程图如下。请完成填空:
(1) 已知A、B的相对分子质量相差16,则A结构简式为_
(2) 写出反应⑤的化学反应方程式
(3)E(乙酸苯甲酯)有多种同分异构体,其中属于酯类、且为一取代苯结构的有
种(不包括E本身),任写其中一种的结构简式。
(4)除图示方法外,请你另设计一种最佳方案由Y制得A(用类似以上流程图表示)
(5)若将反应③、④的条件做如下变动,将先后得到 、
、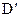 而得不到
而得不到 、
、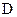 :
:
已知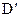 与
与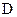 的分子式相同,且
的分子式相同,且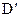 可与
可与 溶液发生显色反应,写出符合条件的由X→
溶液发生显色反应,写出符合条件的由X→ (
( 的一硝基代物有2种)的反应方程式_______。
的一硝基代物有2种)的反应方程式_______。