下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量低于反应物总能量时,反应吸热 |
| B.有热量变化时一定发生了化学变化 |
| C.依据盖斯定律,可计算某些难以直接测定的△H |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
在密闭容器中,一定量混合气体发生下列反应: aM(g)+bN(g)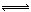 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是()
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是()
| A.反应速率增大 | B.平衡向正反应方向移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
25℃时,下列说法不正确的是()
| A.NaHCO3溶液和Na2CO3溶液中含有的粒子种类完全相同 |
| B.用一定浓度的NaOH溶液滴定氢氟酸,当pH=6时,溶液中c(F-)-c(Na+)=9.9×10-7mol/L |
| C.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同 |
| D.用0.2 mol/L NaOH溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
在由水电离出的c(H+)= 1×10-13 mol/L的溶液中,一定可以大量共存的是()
| A.Ba2+ Na+ NO3- Cl- | B.Fe2+ Na+ NO3- Cl- |
| C.SO42- S2O2- 3 NH4+ Na+ | D.Mg2+ Na+ Br- AlO2- |
下列原理所测的中和热最接近-57.3 kJ/mol的是()
| A.将标况下11.2L HCl气体通入50mL 0.01 mol/L NaOH溶液中反应 |
| B.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L HNO3溶液反应 |
| C.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L H2SO4溶液反应 |
| D.用55mL 0.01 mol/L NaOH溶液与50mL 0.01 mol/L HF溶液反应 |
对水的电离平衡不产生影响的粒子是( )
| A.Fe3+ | B.Cl- | C.HCl | D.CH3COO- |