你认为下列实验方案中,可行的是
| A.按溶解、过滤、蒸发的操作顺序可以分离 CaCl2、CaCO3的混合物 |
| B.向某种未知溶液中加入 AgNO3溶液,产生白色沉淀,证明溶液是盐酸 |
| C.用镁在密闭容器中燃烧,除去密闭容器内空气中的氧气 |
| D.将 pH 试纸润湿后,用玻璃棒蘸取食用白醋滴在试纸上,测定其pH |
下列有关离子方程式与所述事实相符且正确的是
| A.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO===BaSO4↓+2H2O |
| B.钠与水反应:Na + 2H2O = Na++ 2OH-+ H2↑ |
| C.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)===Fe(OH)3↓+3 H+ |
| D.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO |
普伐他汀是一种调节血脂的药物,其结构如右图所示(未表示出其空间构型)。下列关系普伐他汀的性质描述正确的是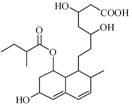
| A.能与FeCl3溶液发生显色反应 |
| B.能使酸性KMnO4溶液褪色 |
| C.1mol该物质与足量钠发生反应生成4molH2 |
| D.1mol该物质最多可与1molNaOH反应 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1L 0.1 mol/L NaHCO3溶液中含有HCO3-数目为0.1NA |
| B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D.1 mol Fe与足量稀HNO3反应,转移电子数目为2NA |
下图装置或操作错误的是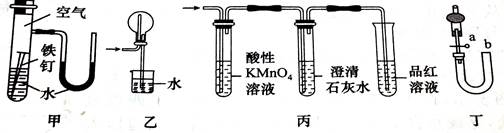
| A.用装置甲验证在该条件下铁钉发生吸氧腐蚀。 |
| B.装置乙用于HCl的吸收,以防倒吸。 |
| C.用装置丙验证实验室制得的乙烯中混有二氧化硫和二氧化碳。 |
| D.关闭活塞a,从b处加水,以检查装置丁的气密性。 |
下列说法不正确的是
| A.Al2O3用作耐火材料、Al(OH)3用作阻燃剂 |
| B.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 |
| C.自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在 |
| D.通过化学变化可以实现12C与14C间的相互转化 |