下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
Fe2+、NO3-、K+ |
稀硫酸 |
3Fe 2++NO3-+4H+===3Fe3++NO↑+2H2O |
| B |
Fe3+、I-、ClO- |
氢氧化钠溶液 |
Fe3++3OH-===Fe(OH)3↓ |
| C |
Ba2+、HCO3-、Cl- |
氢氧化钠溶液 |
HCO3-+OH-===CO32-+H2O |
| D |
Al3+、Cl-、NO3- |
过量氢氧化钠溶液 |
Al3++3OH-===Al(OH)3↓ |
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
| A.X2YZ4 | B.XYZ3 | C.X3YZ4 | D.X4Y2Z7 |
在一定条件下,在体积固定的密闭容器中进行的可逆反应N2 +3H2 2NH3,下列说法能表明该反应达到平衡状态的是()
2NH3,下列说法能表明该反应达到平衡状态的是()
| A.生成氨的速率与分解氨的速率相等 |
| B.断开一个N≡N,同时有六个N-H键生成 |
| C.N2、H2,、NH3的浓度相等 |
| D.混合气体总压不再改变 |
关于下列图示的说法中正确的是()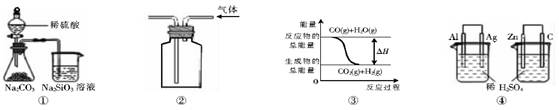
| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示可逆反应CO(g)+H2O(g)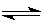 CO2(g)+H2(g)的△H小于0 CO2(g)+H2(g)的△H小于0 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
在下列溶液中,各组离子一定能够大量共存的是
| A.使酚酞试液变红的溶液: Na+、Cl-、SO、Fe3+ |
| B.pH=1的溶液中: Na+、Fe3+、NO3-、SO42- |
| C.无色溶液中:K+、Na+、MnO4-、SO42- |
| D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO、Cl- |
下列离子方程式正确的是()
| A.少量AlCl3溶液滴入过量的NaOH溶液中:Al3++4OH-= AlO2-+2H2O |
| B.将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ |
| C.FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
D.氯气溶解于水:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |