质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
| A.大于2c mol/L | B.等于2c mol/L |
| C.小于2c mol/L | D.在c mol/L-2c mol/L之间 |
已知硒酸钠中各元素的质量分数为:Na -a,Se-b,其余为氧;硫酸钠中各元素的质量分数为:Na -c,S-d,其余为氧;用以上数据测定Se元素的相对原子质量时,还需要用到的数据是
| A.Na元素的相对原子质量 | B.S元素的相对原子质量 |
| C.O元素的相对原子质量 | D.Se元素各同位素的丰度 |
有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是
A.NaBr(s)+H3PO4(浓)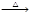 NaH2PO4(aq)+ HBr(g) NaH2PO4(aq)+ HBr(g) |
B.6CaO(l)+2Al(l)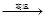 3CaO•Al2O3(s) +3Ca(g) 3CaO•Al2O3(s) +3Ca(g) |
| C.CaCO3(s) +2HCl(aq) →CaCl2(aq) +H2O (l) +CO2(g) |
| D.KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq) +S(s) |
一定条件下,卤代烃和金属钠能发生伍兹反应:RX +2Na+ R,X→R-R,+2NaX,反应中有C-X键
的断裂和C-C键的形成。据此,以下卤代烃伍兹反应的可能产物(不考虑NaX)及命名合理的是
| A.一氯甲烷和2-氯丙烷:正丁烷 |
| B.2,2-二甲基-1-氯丙烷与一氯甲烷:3,3-二甲基丁烷 |
| C.1,5-二氯戊烷:环戊烷 |
| D.四氯化碳:金刚石 |
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。20.2g该样品与100 mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
| A.78 | B.140 | C.156 | D.172 |
已知:红矾钾(K2Cr2O7)和红矾钠(Na2Cr2O7)的溶解度都随温度的升高而增大。根据溶解度差异,工业上用红矾钠、氯化钾制备红矾钾,反应原理为Na2Cr2O7+ 2KCl→K2Cr2O7↓+2 NaCl
实验室模拟工业生产制备红矾钾时,合理的操作步骤是
| A.称量、溶解、蒸发结晶、过滤、洗涤、干燥 |
| B.称量、溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
| C.溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
| D.溶解、蒸发结晶、过滤、洗涤、干燥 |