I.某一反应体系中有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:____________ __。
(4) 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+===Mn2++4H2O ①
MnO4-+3e-+2H2O===MnO2↓+4OH-②
MnO4-+e-===MnO42-(溶液绿色) ③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
①________KMnO4+________K2S+______( )===
________K2MnO4+________K2SO4+________S↓+______( )。
②若生成6.4g单质硫,反应过程中转移电子的物质的量为________。
最近国外研究出一种高效的水果长期保鲜新技术:在3℃潮湿条件下的水果保鲜室中用一种特制的低压水银灯照射,引起光化学反应,使水果贮存过程中缓缓释放的催熟剂转化为没有催熟作用的有机物。试回答:
(1)可能较长期保鲜的主要原因是__________________________________________。
(2)写出主要反应的化学方程式___________________________________________。
下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上: (1)CH3—CH—CH2—CH3 2—乙基丁烷
(1)CH3—CH—CH2—CH3 2—乙基丁烷 CH2
CH2
CH3
 (2)CH3—CH—CH—CH3 3,4—二甲基戊烷
(2)CH3—CH—CH—CH3 3,4—二甲基戊烷 CH3 CH2
CH3 CH2
CH3
 CH3—CH2—CH2CH2—CH3
CH3—CH2—CH2CH2—CH3
 (3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷
(3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷 CH2 CH3
CH2 CH3
CH3
用金属钠制取 通常采用下法:
通常采用下法: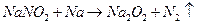 ,试说明不采用钠在氧气中燃烧而用此法制取
,试说明不采用钠在氧气中燃烧而用此法制取 的原因:
的原因:
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.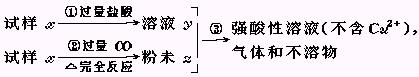
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
在三个密闭容器内分别装有:A.Na2O2和NaHCO3,B.Na2O2和NH4HCO3,C.Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体,写出各容器内残留的固体物质名称及其物质的量。A ,B ,C ,如分别加入相同浓度的足量稀H2SO4与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为 。