(1)已知常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②H2O(l)=H2O(g) △H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式_____________________。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。工业上用如下方法好处甲醇:
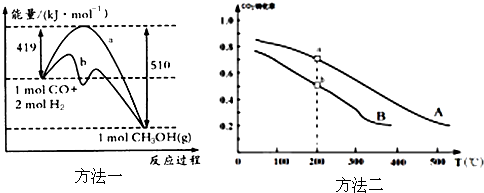
①方法一:该反应的△S_____0(填“>”或“<”)。图中曲线a到曲线b的措施是_________,恒温恒容时,下列说法能说明反应到达平衡状态的是________。
| A.体系的平均摩尔质量不再改变 | B.V(CO)=V(CH3OH) |
| C.H2的转化率达到了最大限度 | D.△H不再改变 |
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:___________;a,b两点化学反应速率别用Va、Vb表示,则Va_____Vb(填“大于”、“小于”或“等于”)。已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法二的原子利用率与方法一的原子利用率之比为___。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式_________。
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg=Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_______________价。
(2)以上反应中的氧化剂为_____________________,当有1 mol CuI参与反应时,转移电子_______________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式: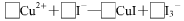
埋藏在地下的青铜器锈蚀过程可以表示为:
(1)青铜器锈蚀过程中的产物有__________________________________________________。
(2)青铜器出土后防止青铜器继续锈蚀的关键是____________________________________。
氢氧化铝与其他的氢氧化物不同,既能与酸反应生成盐和水,又能与碱反应生成盐和水,试用离子方程式表示它与酸和碱反应的原理。
氢氧化亚铁与氢氧化铁都是铁的氢氧化物,它们有什么异同?