将W1 g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥、称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是
| A.石灰水W1 <W2 | B.CO W1 = W2 |
| C.NaHSO4 W1 >W2 | D.乙醇溶液W1 <W2 |
已知I2+SO32—+H2O==2I—+SO42—+2H+。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液的判断正确的是
①肯定不含I-②肯定不含Cu2+③肯定含有SO32-④可能含有I-
| A.②③④ | B.①②③ |
| C.①③ | D.①② |
下列依据热化学方程式得出的结论正确的是
| A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ |
| B.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1 |
| C.已知2C(s)+2O2(g)=2CO2(g)△H=a,2C(s)+O2(g)=2CO(g)△H=b,则a>b |
| D.已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
为使Fe2+,Fe3+,Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH7.7、pH4.5、pH6.6。某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是
| A.H2O2,ZnO | B.氨水 |
| C.KMnO4,ZnCO3 | D.NaOH溶液 |
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是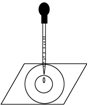
| A.此实验表明氯水具有酸性、漂白性 |
| B.内环呈白色,外环呈红色或浅红 |
| C.内外环上颜色的差异表明氯水中含有H+、HClO等粒子 |
| D.久置的氯水滴到蓝色石蕊试纸上,会出现与上述相同的现象 |
短周期元素组成的物质Q,发生如下反应: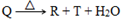 ,下列说法正确的是
,下列说法正确的是
| A.Q一定含三种元素 |
| B.Q一定含有金属元素 |
| C.Q一定不是碱 |
| D.R与T中一定有一种盐 |