下列说法中不正确的是
①水分子的电子式为 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
| A.①② | B.③④ | C.①④ | D.②③ |
下列说法中正确的是
| A.摩尔是物质质量的单位,用“mol”表示 |
| B.标准状况下,气体摩尔体积约为22.4 mol/L |
C.阿伏伽德罗常数的真实值为 6.02×1023 6.02×1023 |
| D.物质的量浓度的常用单位是mol/L |
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比。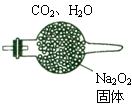
某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。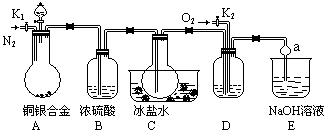
(1)写出A中铜与硝酸反应的一个化学方程式_________________________________
(2)反应前先打开A部分的活塞K1,持续通入一段时间的N2,理由是_________________
若装置中缺少B部分,会影响验证的结果,其原因是___________________________
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是________
_______________________
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为_____mol;
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是______________。
相对分子质量为M的气态化合物V L(标准状况),溶于mg水中,得到质量分数为w%的溶液,物质的量浓度为cmol/L,密度为ρ g·cm-3,则下列说法正确的是()
A.相对分子质量M= |
B.物质的量浓度c=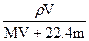 |
C.溶液的质量分数w%=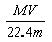 |
D.溶液密度ρ=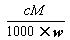 |
把NaHCO3和Na2CO3·10H2O混和物6.56g溶于水制成100mL溶液,测得溶液中c(Na+)
=0.5mol/L。向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为
()
| A.2.93 g | B.5.85 g | C.6.56g | D.无法确定 |