下列有关NA的说法正确的是
| A.18g D2O和18g H2O中含有的质子数均为10NA |
| B.2L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是()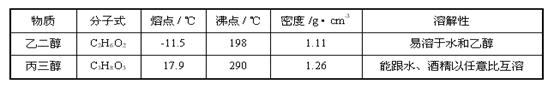
| A.萃取法 | B.结晶法 | C.分液法 | D.蒸馏法 |
下列说法正确的是(NA表示阿伏加德罗常数的数值) ()
| A.在常温常压下,11.2 L N2含有的分子数为0.5 NA |
| B.在常温常压下,1 mol Ne含有的原子数为NA |
| C.22.4L Cl2所含原子数为2NA |
| D.在同温同压时,相同体积的任何气体单质所含的原子数相同 |
下列数量的各物质所含原子数按由大到小顺序排列的是()
①0.5molNH3 ②标况下22.4LHe ③4℃时18mL水 ④0.8molH3PO4
| A.①④③② | B.④③②① | C.②③④① | D.④③①② |
现有三组溶液(1)汽油和氯化钠溶液;(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液;以上混合溶液分离的正确方法依次是()
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
分离下列混合物,按溶解、过滤、蒸发顺序进行的是()
| A.氧化铜、木炭 | B.碳酸钙、氯化钠 |
| C.硝酸钾、氯化钠 | D.乙醇、水 |