(8 分)氯化铁是常见的水处理剂,无水FeCl3 的熔点为282℃,沸点为315℃。工业上制备无水FeCl3 的一种工艺流程如下:
(1)氯化铁能用作水处理剂的原因是_________________(用必要的文字和化学方程式说明)。
(2)吸收塔中吸收剂X 是_______。
(3)温度超过400℃时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为________。
(4)从副产物FeCl3溶液中获得FeCl3·6H2O 的方法是在滴加浓盐酸后,________、________、过滤,洗涤、晾干。
(5)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。用化学方法回收废液中铜的方法是______________(用反应式表示并简述操作要点)。
(8分)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料。已知CuSO4·5H2O的部分结构可表示如下: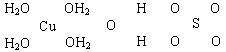
(1)与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有__________(填元素符号)。
(2)请在上图中把CuSO4·5H2O结构中的化学键用短线“——”表示出来。
(3)往浓CuSO4溶液中加入过量较浓的NH3·H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层,静置。经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是______________________________________。
(4)如将深蓝色溶液加热,可能得到什么结果?_______________________ _________。
_________。
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有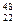 Ti和
Ti和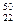 Ti两种原子,它们互称为。Ti元素在元素周期表中的位置是第周期,第族;基态原子的电子排布式为;按电子排布Ti元素在元素周期表分区中属于区元素
Ti两种原子,它们互称为。Ti元素在元素周期表中的位置是第周期,第族;基态原子的电子排布式为;按电子排布Ti元素在元素周期表分区中属于区元素
(2)偏钛酸 钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是
钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是。
| A.苯与B3N3H6互为等电子体 |
| B.甲醛、苯分子中碳原子均采用sp2杂化 |
| C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |
某元素最高价氧化物的水化物的化学式为 HxROy,气态氢化物的化学式为HxR , 已知 1 mol的HxROy比 1 mol 的HxR 质量多 64 g,又知道1 mol的HxROy中R的原子核外电子总数比1 mol的HxROy中氢原子和氧原子核外电子总数少16 mol。求:
x=R的原子序数为
同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
⑴已 知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号);
知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号);
(2)已知P4、NH4+、N4H44+的空间结构均为正四面体结构,请画出N4H44+的结构式(用“→”表示配位键) 。N4H44+与NaOH溶液反应的离子方程式
。N4H44+与NaOH溶液反应的离子方程式 。
。
A、B、C、D是四种短周期主族元素,其中B的原子序数最小。A、B同主族,C、D同主族。A比C的核外少两个电子;D元素一种原子的质量数是其质子数的两倍多2,又是该原子最外层电子数的3倍。判断A、B、C、D各 是什么元素:
是什么元素:
ABCD