下列操作能达到目的的是
| A.将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体 |
| B.向NaAlO2溶液中加入过量的AlCl3溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的Al(OH)3固体 |
| C.把铝块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体 |
| D.把AlCl3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体 |
下面有关电化学的图示,完全正确的是()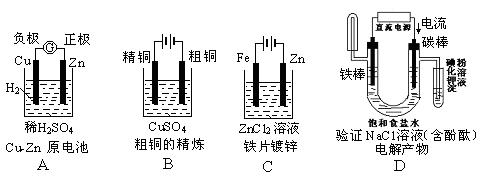
下列热化学方程式书写正确的是()
A.2SO2+O2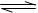 2SO3;△H=-196.6kJ/mol 2SO3;△H=-196.6kJ/mol |
| B.C(s)+O2(g)==CO2(g);△H=393.5kJ/mol |
| C.1/2H2(g)+1/2Cl2(g)==HCl(g);△H=-92.5kJ/mol |
| D.H+(aq)+OH-(aq)==H2O(l);△H=57.3kJ |
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28 g时,B中电极上银增加的质量为()
A.4.32 g B.2.16 g C.1.08 g D.0.54 g
Li﹣Al/FeS电池是一种正在开发的电动车用二次电池,该电池反应式为:2Al+6Li++3FeS=2Al3++3Li2S+3Fe.有关该电池的下列说法中,错误的是()
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li﹣Al在电池中作为负极材料,负极的电极反应式为Li﹣e﹣=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阳极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在pH=5时早已完全沉淀。其分析错误的是()
| A.用18.4mol/L浓硫酸配制溶解所用4.00mol/L的稀硫酸,玻璃仪器一般只有4种 |
| B.利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 |
| C.洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 |
| D.若要测定所得硫酸铜晶体中结晶水的数目,实验中要用到坩埚、坩埚钳和干燥器等 |