铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________;
如图所示,为光电计时器的实验简易示意图,当有不透光物体从光电门间通过时,光电计时器就可以显示物体的挡光时间,实验中所选用的光电门传感器可测的最短时间为0.01ms.光滑水平导轨MN上放两个相同物块A和B,其宽度a =3.0×10-2m,左端挡板处有一弹射装置P,右端N处与水平传送带平滑连接,今将挡光效果好,宽度为d =3.6×10-3m的两块黑色磁带分别贴在物块A和B上,且高出物块,并使高出物块部分在通过光电门时挡光.传送带水平部分的长度L =8m,沿逆时针方向以恒定速度v =6m/s匀速传动.物块A、B与传送带间的动摩擦因数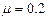 ,质量mA =mB =1kg.开始时在A和B之间压缩一轻弹簧,锁定其处于静止状态,现解除锁定,弹开物块A和B,迅速移去轻弹簧,两物块第一次通过光电门,计时器显示读数均为t =9.0×10-4s. g取10m/s2.试求:
,质量mA =mB =1kg.开始时在A和B之间压缩一轻弹簧,锁定其处于静止状态,现解除锁定,弹开物块A和B,迅速移去轻弹簧,两物块第一次通过光电门,计时器显示读数均为t =9.0×10-4s. g取10m/s2.试求:
(1)弹簧储存的弹性势能EP;
(2)物块B沿传送带向右滑动的最远距离sm;
(3)物块B滑回水平面MN的速度大小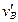 ;
;
(4)若物体B返回水平面MN后与被弹射装置P弹回的物块A在水平面上相碰,且A和B碰后互换速度,则弹射装置P至少必须对物块A做多少功,才能在AB碰后使B刚好能从Q端滑出?此过程中,滑块B与传送带之间因摩擦产生的内能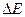 为多大?
为多大?
如图所示,一根长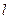 =0.8m轻绳一端固定在O点,另一端栓一质量m=0.1kg的小球静止于A点,其右方有底面半径r=0.2m的转筒,转筒顶端与A等高,下部有一小孔,距顶端h=0.8m。现使细绳处于水平线上方30°的位置B点处而伸直,且与转筒的轴线、OA在同一竖直平面内,开始时小孔也在这一竖直平面内。将小球由B点静止释放,当小球经过A点时轻绳突然断掉,同时触动了光电装置,使转筒立刻以某一角速度匀速转动起来,且小球最终正好进入小孔。不计空气阻力,g取l0m/s2。试求:
=0.8m轻绳一端固定在O点,另一端栓一质量m=0.1kg的小球静止于A点,其右方有底面半径r=0.2m的转筒,转筒顶端与A等高,下部有一小孔,距顶端h=0.8m。现使细绳处于水平线上方30°的位置B点处而伸直,且与转筒的轴线、OA在同一竖直平面内,开始时小孔也在这一竖直平面内。将小球由B点静止释放,当小球经过A点时轻绳突然断掉,同时触动了光电装置,使转筒立刻以某一角速度匀速转动起来,且小球最终正好进入小孔。不计空气阻力,g取l0m/s2。试求:
(1)小球到达A点时的速率?
(2)转筒轴线距A点的距离L和转筒转动的角速度ω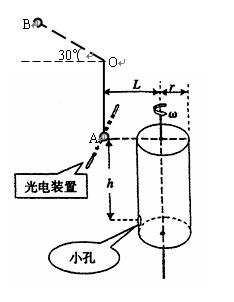
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为 0.5mol(填“大于”、“等于”或“小于”),原因是。
(2)870g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?
0.6molX气体和0.6molY气体混合于2L的密闭容器中,发生如下反应:
2X(g)+ Y(g) nZ(g)+2W(g)
nZ(g)+2W(g)
2min末生产0.2molW,若测得以Z的物质的量浓度变化表示的反应速率为0.1mol▪L-1▪min-1,则前2min内,用X的物质的量浓度变化表示的平均反应速率为;2min末Y的物质的量浓度为;Z的化学计量数n=。
在由铜片、锌片和200 mL稀硫酸组成的原电池中,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质量是克;
(2)通过导线的电子的物质的量是mol
(3)原稀硫酸的物质的量浓度是mol/L