下列陈述I、Ⅱ正确并且有因果关系的是
| 选项 |
表述I |
表述II |
| A |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| B |
SO2有漂白性 |
SO2可使溴水褪色 |
| C |
溶液中含有大量的NO3- |
溶液中不能存在大量I-或S2- |
| D |
将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 |
半透膜有破损 |
下列事实中一定不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④pH=1的CH3COOH溶液和pH=13的KOH溶液等体积混合,溶液呈酸性
⑤CH3COONa和稀H3PO4反应,生成CH3COOH
⑥pH=1的CH3COOH溶液稀释至100倍,pH<3
⑦10ml0.1mol.L-1CH3COOH恰好与10ml0.1mol.L-1NaOH溶液完全反应
| A.②⑦ | B.②⑤ | C.①③⑤ | D.②④⑤⑥ |
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH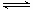 CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 |
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O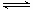 H++OH-逆向移动,c(H+)降低 H++OH-逆向移动,c(H+)降低 |
| C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下反应,起始时醋酸与锌反应的速率大 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-) |
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH。下列说法不正确的是
| A.浓度均为0.1mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强 |
| B.0.1mol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小 |
| C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒 |
| D.NaF溶液中加入少量NaOH固体,溶液中c(F-)增大 |
常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反应,产生CO2的体积
| A.同样多 | B.HCl最多 |
| C.HCl、HNO3一样多 | D.CH3COOH最少 |
下列叙述正确的是
| A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 |
B.溶液中c(H )越大,pH也越大,溶液的酸性就越强 )越大,pH也越大,溶液的酸性就越强 |
| C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 |
| D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |