近年来科学家利用合成的方法制备了多种具有特殊结构的有机物,例如具有下列立体结构的环状化合物(其中碳、氢原子均已略去):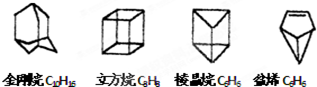
有人认为上述有机物中,①立方烷,棱晶烷、金刚烷可以看作是烷烃的同系物;②盆烯是单烯烃;③棱晶烷、盆烯是苯的同分异构体;④金刚烷是癸炔的同分异构体。以上叙述正确的是
| A.③ | B.①和③ | C.②和④ | D.除①外都正确 |
根据20℃时某些物质的溶解度(g)数据:
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
下列说法不正确的是
A.硫酸钙悬浊液中存在CaSO4(s) Ca2+(aq)+ SO42-(aq)
Ca2+(aq)+ SO42-(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,说明溶解度Fe(OH)3< Mg(OH)2
D.向2ml饱和MgCl2溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
ClO2是一种高效安全的绿色杀菌剂,下列有关ClO2制备与杀菌的说法不合理的是
| A.可用Cl2和NaClO2制备ClO2, 其中n (氧化剂) : n (还原剂) = 1:2 |
| B.ClO2在强碱性环境中使用失效:2ClO2+2OH-=ClO3-+ClO2-+H2O |
| C.ClO2处理饮用水时残留的ClO2-,可用FeSO4来除去: ClO2-+2Fe2++4H+=2Fe3++Cl-+2H2O |
| D.等物质的量的ClO2杀菌效果比Cl2、HClO强 |
CO和H2在ThNi5作用下可以合成CH4。
已知温度为T时:① CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1
② CH4(g)+2H2O(g) === 4H2(g) + CO2(g) ΔH=+165 kJ·mol-1
下列说法不正确的是
| A.催化剂不能改变该反应的ΔH |
| B.①中反应物的键能总和小于生成物的键能总和 |
| C.②中反应物的总能量高于生成物的总能量 |
| D.CO(g)与H2(g)合成CH4(g)的反应为放热反应 |
为了控制温室效应,工业上可用CO2来生产甲醇。一定条件下,在体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH>0
CH3OH(g)+H2O(g) ΔH>0
下列说法正确的是
| A.升高温度,该反应的平衡常数增大 |
| B.当v(CO2):v (H2)=1:3时,反应达到平衡 |
| C.当 c(CH3OH) = 1mol·L-1时,反应达到平衡 |
| D.平衡后再充入一定量的CO2,甲醇的体积分数一定增大 |
人体血液呈弱碱性,pH在7.35~7.45之间,超出范围会引起酸或碱中毒。
下列有关血液说法不合理的是
A.血液中溶解的CO2有平衡存在:CO2 + H2O  H2CO3 H2CO3 H++HCO3- H++HCO3- |
| B.当pH<7.35时造成酸中毒,可静脉滴注NaHCO3溶液解毒 |
| C.病人心肺复苏时大量使用NaHCO3,会造成血液的pH升高,引起碱中毒 |
| D.取一定量pH=8.1的血液稀释到原体积的10倍,pH=7.1 |