NA为阿伏加德罗常数的值。下列说法正确的是
| A.18gD2O和18gH2O中含有的质子数均为10NA |
| B.2 L 0.5mol/L亚硫酸溶液中含有的H+离子数为2NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2NA |
下图为番茄电池,下列说法正确的是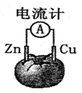
| A.一段时间后,锌片质量会变小 |
| B.铜电极附近会出现蓝色 |
| C.电子由铜通过导线流向锌 |
| D.锌电极是该电池的正极 |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp等于c点对应的Ksp |
| C.向d点溶液中加入适量CaCl2固体可以变到c点 |
| D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
已知25 ℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
| A.25 ℃时,当溶液中c(Ba2+)·c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 |
| B.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| C.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO32-)∶c(SO42-)≈24.11 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
有关AgCl的沉淀溶解平衡的说法正确的是
| A.AgCl难溶于水,溶液中没有Ag+和Cl- |
| B.AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| C.向AgCl溶液中加入盐酸,一定会有沉淀生成 |
| D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
下列有关沉淀平衡的说法中正确的是
| A.在AgCl的沉淀溶解平衡体系中加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |