下列化学反应的离子方程式正确的是
| A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列化学式,只表示一种纯净物的是
| A.C2H6O | B.C2H4 | C.C | D.C4H10 |
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器。左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体。同时引燃左右两侧的混合气,反应后恢复到标准状况,反应前后活塞位置如下图所示,则右侧混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)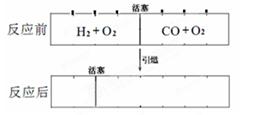
将等物质的量的金属Na、Mg、Al分别与100mL 2mol/L的盐酸反应,生成气体的体积均为VL(标准状况下),已知:2Na+2H2O=2NaOH+H2,下列说法错误的是
| A.反应中,三种金属中有两种金属过量 |
| B.参加反应的金属Na 、 Mg、 Al的物质的量之比为6:3:2 |
| C.镁的物质的量为0.1mol |
| D.V=2.24 |
质量分数为n的硫酸溶液,其物质的量浓度a mol/L为,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为b mol/L,则与的关系正确的是
| A.b=2a | B.a=2b | C.b﹥2a | D.b﹤2a |
取含有 0.02 mol 的硫酸溶液,先投入 0.24 g 镁粉,再滴入NaOH 溶液,当使溶液中的镁离子全部转化为沉淀时, 需要NaOH的物质的量为
| A.0.02 mol | B.0.03 mol | C.0.04 mol | D.0.01 mol |