在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
| A.气体A与气体B的相对分子质量比为m∶n |
| B.同质量的气体A与B的分子个数比为n∶m |
| C.同温同压下,A气体与B气体的密度比为n∶m |
| D.同温同压下,同体积的A气体与B气体的质量比为m∶n |
对于放热反应:H2+Cl2 2HCl,下列说法错误的是
2HCl,下列说法错误的是
| A.反应物的总能量大于生成物的总能量 |
| B.该反应遵循“能量守恒定律” |
| C.该反应中,化学能只转变成热能 |
| D.断开1molH-H键和1molCl-Cl键所吸收的总能量小于形成2molH-Cl键所放出的能量 |
有关化学键和化合物的叙述不正确的是
| A.盐酸中含有H+和Cl-,所以HCl是离子化合物 |
| B.Na2O2中含有离子键和非极性共价键 |
| C.完全由非金属元素组成的化合物可能是离子化合物 |
| D.双原子或多原子的单质分子中均存在化学键 |
X、Y、Z均为短周期元素,在周期表中的位置如下图所示,下列叙述正确的是
| Z |
||
| Y |
||
| X |
A.X一定是活泼金属
B.Y的最高价氧化物是酸性氧化物
C.Z的单质是双原子分子
D.氢化物的稳定性:Y>X
人剧烈运动,会因骨骼肌组织供氧不足,导致葡萄糖无氧氧化,产生大量酸性物质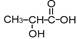 ,该物质大量堆积于腿部会引起肌肉酸痛。该物质体现酸性的官能团是
,该物质大量堆积于腿部会引起肌肉酸痛。该物质体现酸性的官能团是
| A.甲基 | B.羰基 | C.羧基 | D.羟基 |
下列叙述错误的是
| A.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)互为同分异构体 |
| B.CH2=CH-CH2-CH3和CH2=CH-CH=CH-CH2-CH3属于同系物 |
| C.石墨与C60是同素异形体 |
| D.1H、2H、3H是氢的三种同位素 |