下列说法正确的是
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)的ΔH<0 |
| B.常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 |
| C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| D.等体积、等物质的量浓度的NH3·H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3·H2O的电离程度小于NH的水解程度 |
下列说法不正确的是
| A.制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 |
| B.培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜 |
| C.铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净 |
| D.做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 |
下列说法不正确的是
| A.在自然界中存在的单质,一定具备化学性质稳定、不与其它物质发生反应这一特征 |
| B.100多年前,英国曾耗巨资改建高炉,试图延长CO和Fe2O3的接触时间,以减少CO的排放,这违背了化学反应都有一定限度这一基本原理 |
| C.在溶液中,有色物质参与的反应,可以用分光光度计来测定其化学反应速率 |
| D.虽然碳酸钙分解需要吸收大量的热,但在高温条件下也能自发进行 |
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、NO2—、AlO2—、CO32-、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是 ( )
| A.气体甲可能为CO2或者SO2 |
| B.沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42—、NO2— |
| D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |
下列各项说法中,不正确的是 ( )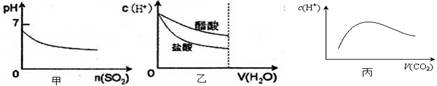
| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
下列说法正确的是()
| A.用酸性高锰酸钾即可鉴别苯酚溶液,2,4-己二烯和甲苯 |
B.按系统命名法化合物  的名称为:2,5,6-三甲基-3-乙基庚烷 的名称为:2,5,6-三甲基-3-乙基庚烷 |
C.新型解热镇痛抗炎药贝诺酯 在酸性条件下完全水解可以得到3种有机物 在酸性条件下完全水解可以得到3种有机物 |
D.β—月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |