一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
下列叙述中错误的是
| A.阿伏加德罗常数的数值与12g12C所含的碳原子数相等 |
| B.在0.5mol Na2SO4中,含有的Na+数约是6.02×1023 |
| C.等物质的量的O2与O3,所含氧原子数相等 |
| D.摩尔是物质的量的单位 |
下列关于金属性质的叙述中正确的是
| A.钠与氧气反应时,产物是由O2的用量决定的 |
| B.铝箔在空气中受热可以熔化且会发生剧燃烧 |
| C.金属与非金属单质发生反应时,被氧化的一定是金属 |
| D.铁丝不论在空气还是纯氧中都不会燃烧 |
下列事故或药品的处理正确的是
| A.一般用药匙取用粉末或块状药品 |
| B.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处 |
| C.制取并收集氧气结束后,应立即停止加热 |
| D.将含硫酸的废液倒入水槽,用水冲入下水道 |
下列图示与对应的叙述相符的是( )
| A.图1表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂改变反应的焓变 |
| B.图2表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| C.图3表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| D.图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应: |
2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
海水中含有多种元素,开发利用这些资源是科学研究的重要课题。下图为海水利用的部分过程,下列有关说法正确的是( )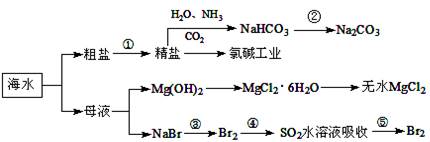
| A.要实现反应②可向NaHCO3溶液中加入过量石灰水 |
| B.氯碱工业中采用阴离子交换膜提高产品纯度 |
| C.MgCl2溶液加热蒸干可得无水MgCl2 |
| D.溴元素在反应③、⑤中均被氧化,在反应④中被还原 |