25℃时,下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.在0.1mol•L-1 NaHCO3溶液中:c(HCO3-)>c(Na+)>c(CO32-)>c(H2CO3) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
下列实验方案正确且能达到相应实验预期目的的是 ( )
 |
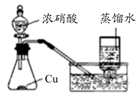 |
 |
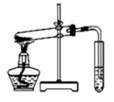 |
| A.制取少量蒸馏水 |
B.制取少量NO2 |
C.比较MnO2、Cl2、I2的氧化性 |
D.探究NH4HCO3的热稳定性 |
可用如图所示装置制取、净化、收集的气体是( )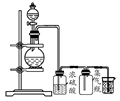
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
某同学为检验溶液中是否含有常见的几种无机离子,进行了如下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )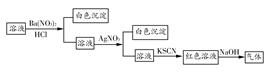
| A.原溶液中一定含有SO42- |
| B.原溶液中一定含有NH4+ |
| C.原溶液中一定含有Cl- |
| D.原溶液中一定含有Fe3+ |
下列有关物质检验的实验结论正确的是( )
| 实验操作 |
现象 |
实验结论 |
|
| A |
向某溶液中加入盐酸酸化的氯化钡溶液 |
有白色沉淀生成 |
溶液中一定含有SO42- |
| B |
将某气体通入澄清石灰水中 |
变浑浊 |
该气体一定是CO2 |
| C |
向某溶液中加入2滴KSCN溶液 |
溶液不显红色 |
溶液中一定含有Fe2 |
| 另取样,先滴入氯水,再滴入KSCN溶液 |
溶液变为红色 |
||
| D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热 |
有银镜生成 |
该物质一定是葡萄糖 |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是( )
| A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.取少量硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.取少量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管中,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+ |